9º ANO – Parte 2
MODELOS
ATÔMICOS
Os
modelos atômicos tentam explicar como a matéria é construída e organizada para
que possamos entender melhor como ocorrem os fenômenos da natureza.
Quando falamos de átomo, logo nos vêm à
mente os diferentes modelos atômicos propostos
ao longo da história da ciência. Os filósofos gregos primeiramente propuseram a
ideia de que a matéria era formada de partículas bem pequenas e que essas
partículas eram indivisíveis. Essas partículas foram denominadas de átomos.
Embora
tenha ficado por muito tempo no esquecimento, a ideia de átomo, ou melhor, a
ideia da existência de uma partícula que fosse indivisível, reapareceu nos
estudos realizados sobre as reações químicas no século XIX.
Com a finalidade de explicar alguns fatos
experimentais observados nas reações químicas, no ano de 1808, o
cientista John
Dalton introduziu a ideia de
que todo e qualquer tipo de matéria seria formado por partículas indivisíveis,
denominadas de átomos.
Com
o passar do tempo, os estudos ficaram cada vez mais profundos na busca de uma
explicação concreta, um modelo atômico útil, pois um modelo só é útil enquanto
explica de forma correta determinado fenômeno ou experimento sem entrar em
conflito com experimentos anteriormente realizados.
Na busca por um modelo plausível, ou
seja, um modelo que melhor explicasse um fenômeno, vários modelos foram elaborados,
mas somente três deles ganharam destaque. São os Modelos de Thomson, Rutherford e Bohr.
O modelo atômico de
Thomson é conhecido como “pudim de
passas” e enuncia que o átomo é uma esfera de carga elétrica positiva, não
maciça e que nele se encontram cargas negativas estáticas distribuídas
uniformemente, de modo que sua carga elétrica total é nula.
MODELO ATÔMICO DE RUTHERFORD
Rutherford, com a intenção de aprofundar seus estudos, foi
para a Inglaterra submeter-se à orientação de Thomson nas investigações sobre
as propriedades dos raios X e das emissões radioativas. Em seus estudos,
ele conseguiu, por meio de experimentos, bombardear uma fina lâmina de ouro com
partículas alfa (núcleo do átomo de hélio). Ele percebeu que a maioria das
partículas alfa emitidas atravessava a lâmina sem sofrer qualquer desvio.
Todavia, uma pequena parte das partículas sofria um desvio. Com isso, ele pôde
concluir que o átomo possuía um pequeno núcleo e uma grande região vazia.
Em seu
experimento, Rutherford enunciou que os elétrons eram dotados de cargas
negativas, mas no núcleo se encontravam as cargas positivas. Dessa forma,
baseando-se no sistema planetário, Rutherford propôs para o átomo de hidrogênio
um modelo semelhante.
MODELO ATÔMICO DE BOHR
Aprofundando-se
no modelo proposto por Rutherford, Niels Bohr, em 1923, conseguiu completá-lo
introduzindo a ideia de que os elétrons só se movem ao redor do núcleo quando
estão alocados em certos níveis de energia. Dessa forma, um elétron só poderia
mudar de nível se ganhasse ou perdesse energia.
Bohr foi questionado sobre o fato de que, se o
elétron emitisse energia sem parar, ele se chocaria com o núcleo, podendo gerar
um colapso. Esse questionamento passou por várias formulações até ser
reformulado pelo cientista Louis de Broglie, que diz que os elétrons giram ao
redor do núcleo, mas não em órbitas definidas como tinha afirmado Bohr.
Fonte: https://descomplica.com.br/artigo/mapa-mental-evolucao-dos-modelos-atomicos/4QQ/
-Consulta em 23/03/20
ESTRUTURA DO ÁTOMO
A estrutura do
átomo é formada pelo núcleo, que é constituído por duas partículas (prótons e
nêutrons), e pela eletrosfera, que detém os elétrons.
Os átomos são
partículas infinitamente pequenas que constituem toda matéria no universo. Ao
longo do tempo, a ideia de como seria a estrutura atômica foi mudando de acordo
com as novas descobertas feitas pelos cientistas.
Um modelo é uma
representação da realidade (não a própria realidade), assim, os modelos
atômicos são representações dos principais componentes do átomo e de sua
estrutura e explicam determinados comportamentos físicos e químicos da matéria.
Isso é feito porque ainda não é possível ao ser humano enxergar um átomo
isolado nem mesmo com ultramicroscópios.
Para se ter uma
ideia do quanto o átomo é pequeno, saiba que a menor partícula visível em um
microscópio comum contém mais de dez bilhões de átomos! O átomo é tão pequeno
que, se colocássemos um milhão deles lado a lado, não atingiríamos a espessura
de um fio de cabelo.
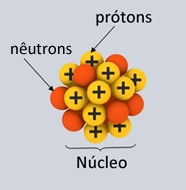
Duas partes
principais da estrutura de um átomo – eletrosfera e núcleo
* Núcleo:
Constituindo-se como a parte central do átomo, ele é compacto, maciço e muito
denso, além de ser formado pelas partículas de maior massa, que são os prótons
e os nêutrons.
- Prótons: são
partículas de carga elétrica positiva.
O fato de que os
prótons formam o núcleo e dão a ele uma carga total positiva foi descoberto por
Eugen Goldstein, em 1886, através de uma modificação na ampola de Crookes e
alguns experimentos. Ele viu que, sob voltagens elevadíssimas, apareciam
emissões (raios anódicos - restos de átomos do gás que estavam dentro da ampola
e que tiveram seus elétrons arrancados pela descarga elétrica). Ao colocar um
campo elétrico ou magnético externo à ampola, esses raios eram desviados no
sentido do polo negativo. Isso significava que existiam partículas subatômicas
positivas, que foram chamadas de prótons.
Mais tarde,
Ernest Rutherford (1871-1937) realizou o experimento descrito no texto O átomo
de Rutherford, que o levou à descoberta da localização do próton: no núcleo.
- Nêutrons: são
partículas de massa igual à dos prótons (1), mas como o próprio nome indica,
eles são neutros, ou seja, não possuem carga elétrica.
Os nêutrons foram
descobertos, em 1932, por James Chadwick (1891-1974), que percebeu que o núcleo
do berílio radioativo emitia partículas neutras com a massa praticamente igual
à massa dos prótons (na verdade, é um pouquinho maior).
O núcleo atômico
concentra praticamente toda a massa do átomo, sendo uma parte muito pequena
mesmo: tanto o próton como o nêutron são cerca de 100 mil vezes menores do que
o próprio átomo inteiro! A título de comparação, imagine que aumentássemos o
núcleo do átomo do elemento hidrogênio (que possui somente um próton) até o
tamanho de uma bola de tênis, o elétron mais próximo ficaria a uns três
quilômetros de distância!
* Eletrosfera: É
uma região onde os elétrons ficam girando ao redor do núcleo. Apesar de ser uma
região de volume muito maior que o do núcleo, ela é praticamente vazia, pois
cada elétron é 1836 vezes menor que 1 próton (ou que 1 nêutron). É por isso que
a massa do átomo concentra-se praticamente toda no núcleo. Os elétrons são
partículas de carga elétrica negativa (-1).
Os elétrons foram
descobertos, em 1897, por Joseph John Thomson (1856-1940), o criador do modelo
atômico de Thomson.
Os elétrons giram
ao redor do núcleo bilhões de vezes por milionésimo de segundo, dando forma ao
átomo e fazendo-o comportar-se como se fosse sólido.
Resumidamente,
podemos fazer uma tabela para diferenciar as três partículas subatômicas
principais que fazem parte da estrutura do átomo:
Massa e carga
elétrica das três partículas subatômicas principais – prótons, nêutrons e
elétrons
Os átomos de
todos os elementos químicos são compostos por essas três partículas
subatômicas. O que difere um elemento químico de outro é a quantidade em que
essas partículas aparecem, principalmente a quantidade de prótons no núcleo,
que é chamada de número atômico.
Fonte: https://brasilescola.uol.com.br/quimica/estrutura-Atomo.htm
-Consulta em 23/03/20
Questão –
1 - Uma importante contribuição do modelo de Rutherford foi considerar o átomo
constituído de:
a)
elétrons mergulhados numa massa homogênea de carga positiva.
b)
uma estrutura altamente compactada de prótons e elétrons.
c)
um núcleo de massa desprezível comparada com a massa do elétron.
d)
uma região central com carga negativa chamada núcleo.
e)
um núcleo muito pequeno de carga positiva, cercada por elétrons.
Questão
- 2 - Relacione as características
atômicas com os cientistas que as propôs:
|
I. Dalton
II. Thomson
III. Rutherford
|
( ) Seu modelo atômico era semelhante a um “pudim de
passas”.
( ) Seu modelo atômico era semelhante a uma bola de bilhar. ( ) Criou um modelo para o átomo semelhante ao “Sistema solar”. |
Questão - 3 - A
descoberta do nêutron, partícula localizada no interior do núcleo do átomo cuja
principal função é estabilizá-lo por meio da diminuição da força de repulsão
entre os elétrons. Entre os cientistas citados a seguir, qual deles foi o
descobridor do nêutron?
a) R. A. Millikan
b) E. Rutherford
c) J. Chadwick
d) J.J. Thomson
e) C. Goldstein
Questão -
4 - A figura abaixo apresenta um modelo
atômico que contribuiu significativamente para o estabelecimento do conceito de
átomo moderno, pois o cientista que o propôs defendia a divisibilidade do átomo
em uma massa protônica positiva e em partículas negativas denominadas elétrons.
Sabendo que o modelo foi denominado pudim com
passas, qual cientista é o responsável por ele?
Questão - 5
- O que é um átomo? Explique
também cada parte que o compõe.






Nenhum comentário:
Postar um comentário